发掘新药候选物质的龙头企业
(株)ENSOL生物科学
ENSOL生物科学公司成立于2001年,与新药候选物质探索平台KISDD(生物大数据基础)共同构建了运用大数据和AI来查明新药候选物质的目标与机制的预测系统ETONS。聚焦全世界尚无治疗方案的疾病,开发以肽为基础的靶向治疗剂,向全球的制药公司转让技术,搭建创造高附加值收益的业务模型。目前已将退行性椎间盘突出治疗剂Peniel 2000(P2K)的制造技术转让给了美国Spine Biopharma公司,预计将进入美国FDA2/3期临床阶段,动物用骨关节炎治疗剂EAD100(产品名称:Joint Bex)的制造技术也已于2020年3月转让给了全球十大动物制药公司。目前,骨关节炎治疗剂Engedi 1000(E1K)正在韩国国内进行1b期临床试验。此外,公司还拥有三阴乳腺癌(TNBC)抗癌剂、阿尔茨海默病治疗剂及一型糖尿病(T1D)治疗剂等新药候选物质,并且正在开发新药。公司凭借这些新药候选物质和技术实力,于2020年8月被选为韩国中小风险企业部主管的预备独角兽支持企业,技术实力和发展潜能得到了认可。
退行性椎间盘突出治疗剂,Peniel 2000(P2K)
退行性腰椎间盘突出(DDD)是慢性腰痛的主要原因之一,该疾病是限制腰痛患者的社会活动、降低其生活质量的主要原因,由为脊柱提供柔韧性的脊椎间冲击吸收组织——腰椎间盘(InterVertebral Disc,IVD)的退化所引起。据推测,全世界有2亿6千万人正在经受着退行性腰椎间盘突出带来的痛苦。在发达国家,日常性腰椎间盘突出的发病率约占人一生的60~70%。腰椎间盘退化是衰老引起的自然现象和不可逆的发展趋势,青少年进入20岁时也可能会产生该疾病,DDD引起的腰痛和运动性低下多发生在30~50多岁的成年人身上。
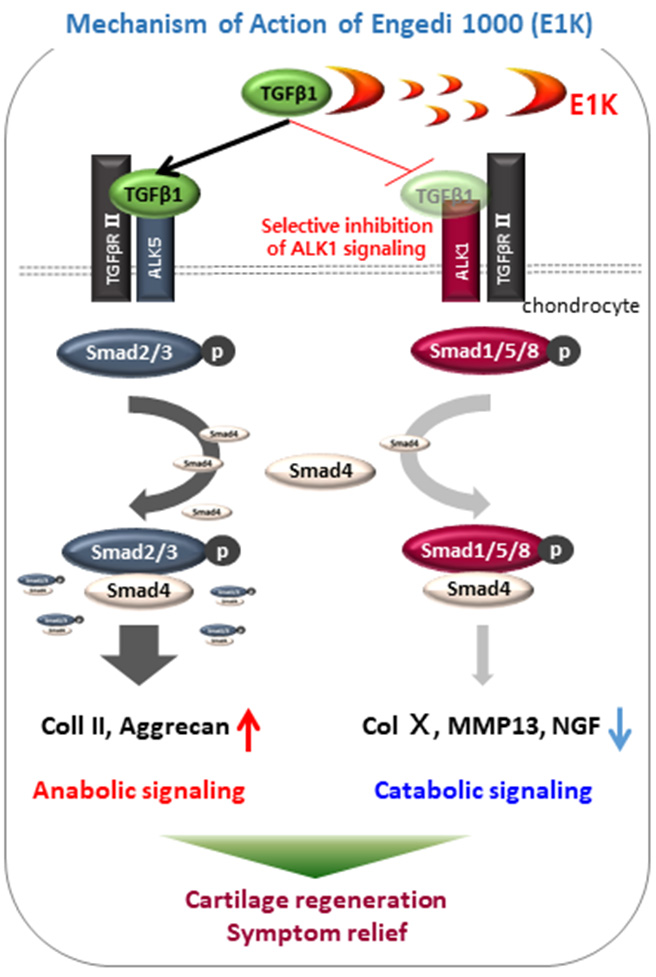
退行性腰椎间盘突出治疗剂“Peniel 2000(P2K)”的第一治疗目标是减轻疼痛,第二治疗目标是使腰椎间盘组织再生。疼痛的腰椎间盘组织呈出现Nerve Growth Factor(NGF,疼痛因子)且神经分布较高的状态,而且还出现了大量TGF-β1,向腰椎间盘内注射P2K能使过多的TGF-β1与P2K相结合,阻碍因TGF-β1而增加的NGF基因,发挥减轻疼痛的功效。此时,与过多出现的TGF-β1相结合,完全阻碍Smad1/5/8信号的传递,并阻碍部分Smad2/3信号的传递,从而仅激活Smad2/3信号传递,增加二型胶原蛋白(Collagen)和Aggrecane基因的产生。增加的二型胶原蛋白将激活腰椎间盘细胞,诱导Extra Cellular Matrix(ECM,细胞外基质)成分的合成,同时使腰椎间盘软骨细胞与髓核细胞的前一阶段——大型脊索细胞(notochordal cell)相结合,促进腰椎间盘再生。
退行性关节炎疾病治疗剂,Engedi 1000(E1K)
退行性关节炎又名退行性关节疾病或骨关节炎,它是伴随关节软骨逐渐消失及其他相关二次变化与症状的疾病。在形成关节的骨骼与骨骼之间发挥冲击吸收作用的关节软骨的逐渐损伤或退化导致形成关节的骨骼、关节膜及周边韧带等部位发生二次损伤,引发疼痛、变形或功能障碍,该病在关节炎症性疾病中的发病率最高。据市场调研机构Technavio的资料(Global Osteoarthritis Therapeutics Market 2020-2024,Technavio)显示,60岁以上的男性骨关节炎患者约占10%,女性约占18%。预计截至2024年,骨关节炎治疗剂的市值将达到100亿美元(约11万亿韩元),这是根据目前以止痛药为主的廉价药物市场结构计算出的数据,治疗剂正式上市的话,预计市场规模将进一步扩大。据韩国健康保险审查评价院推算,2019年韩国骨关节炎患者超过400万人。
骨关节炎治疗剂“Engedi 1000(E1K)”的治疗方向与P2K类似,差别在于它不影响Smad2/3信号的传递,仅限制Smad1/5/8信号传递。ENSOL生物科学公司的退行性腰椎间盘突出治疗剂Peniel 2000(P2K)和骨关节炎治疗剂Engedi 1000(E1K)均为生物来源短肽。简单来说,这两种治疗剂均不是利用化学合成方式制造的地球上不存在的物质,而是生物中存在的蛋白质的部分核心氨基酸链。在假设所有脊椎动物的体内都存在防止软骨退化的再生物质的前提下,找到了主要脊椎动物共同存在的物质,并将其合成为药物。ENSOL生物科学公司在进行人体临床试验的同时,还进行了动物临床试验,2020年2月动物骨关节炎药已率先获得批准,目前正在向600多家动物医院供货,被广泛用作宠物狗的治疗剂。现有的许多药物在动物实验中有效果,但对人类没有效果。ENSOL生物科学公司的P2K和E1K不仅是狗等脊椎动物和人体内都存在并发挥功能的物质,所以成功的可能性应该更大。
E1K在韩国国内完成了1a期临床试验后,于上月4月发表了试验结果。面向24名患者实施临床试验的结果显示,安全性评估因数活力征兆、心电图检查和实验室检查均未发生异常结果或异常反应。通过此次临床试验证明了,E1K是对人体无毒的安全治疗剂。另外还展示了在注射后2周和4周时,对比安慰剂的疼痛改善(VAS)倾向性,结果与动物的疼痛改善结果相符合,这表明E1K是人类也可以使用的药物,具有极高的成功潜能。
ENSOL生物科学公司相信,在不远的将来,人类将在P2K和E1K的帮助下摆脱退行性腰椎间盘突出和骨关节炎疾病。



 Specialized Medical Service
Specialized Medical Service
 Bio Technology
Bio Technology
 Health & Wellness
Health & Wellness
 City & Culture
City & Culture
 Hot Issue
Hot Issue
 Interview With
Interview With
 Medical Technology
Medical Technology
 City & Culture
City & Culture
 Food & Travel
Food & Travel
 Health & Wellness Tips
Health & Wellness Tips
 Hot Issue
Hot Issue